Systemimmunologie und Einzelzell-Biologie
Dr. Felix Hartmann
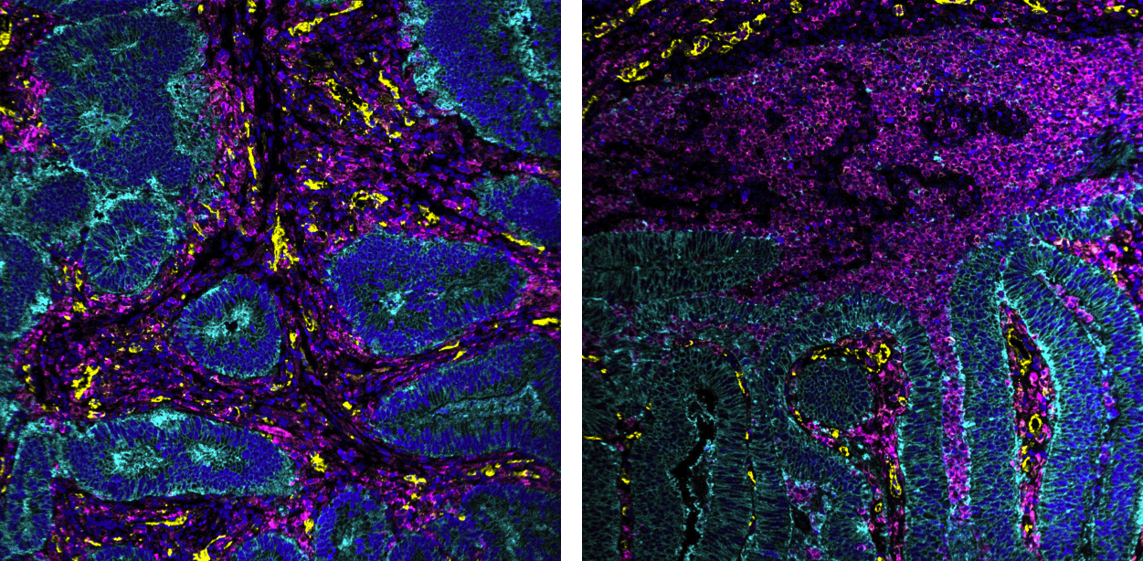
Unser Forschungsschwerpunkt liegt auf den entscheidenden Interaktionen innerhalb der Gewebemikroumgebung, die den Verlauf und das klinische Outcome menschlicher Krebserkrankungen beeinflussen. Wir möchten verstehen, wie diese Wechselwirkungen das Verhalten des menschlichen Immunsystems prägen – mit besonderem Fokus auf den metabolischen Austausch zwischen T-Zellen, Makrophagen und Tumorzellen – und wie diese Interaktionen die Immunfunktion und das Tumorwachstum steuern.
Zur Untersuchung dieser komplexen Zusammenhänge setzen wir eine innovative proteomische Bildgebungstechnologie ein: Multiplexed Ion Beam Imaging (MIBI). Mit MIBI lassen sich gleichzeitig mehr als 40 Proteine quantifizieren und ihre räumliche Verteilung direkt in menschlichem Gewebe darstellen. Am DKFZ haben wir die MIBI-Technologie erfolgreich etabliert und sämtliche experimentellen wie analytischen Workflows aufgebaut. Diese Möglichkeiten nutzen wir nun, um die metabolische Regulation von Immunzellen in klinischen Gewebeproben zu untersuchen. Ergänzend führen wir funktionelle Studien zur Bedeutung zentraler Stoffwechselwege mithilfe genetischer Manipulationen und humaner Organoidkulturen durch.
Unsere Forschung integriert folgende Ansätze:
- Systemimmunologie: Mithilfe von Multiplex-Bildgebung analysieren wir das Immunsystem direkt im menschlichen Gewebe. In Zusammenarbeit mit klinischen Partnern charakterisieren wir Proben aus klinischen Studien zu verschiedenen Tumorentitäten, darunter Kolorektalkarzinom, Melanom und Brustkrebs.
- Einzelzellbiologie: Wir entwickeln experimentelle Methoden, um neue Aspekte der Zellbiologie auf Einzelzellebene zu erforschen – insbesondere den Zusammenhang zwischen metabolischer Reprogrammierung und epigenetischen Modifikationen.
- Computational Biology: Gemeinsam mit Bioinformatiker:innen wenden wir maschinelles Lernen auf unsere hochdimensionalen Bildgebungsdatensätze an, um detaillierte Einblicke auf Einzelzell- und Subzellebene zu gewinnen.
Ziel unserer Arbeitsgruppe ist es, das Zusammenspiel zwischen Immunsystem und lokaler Gewebearchitektur besser zu verstehen, um dadurch zur Entwicklung verbesserter Immuntherapien gegen Krebserkrankungen beizutragen.
Zukünftige Projekte und Ziele
Unsere Gruppe nutzt MIBI-TOF, um systematisch die Heterogenität, räumliche Verteilung und klinische Relevanz metabolischer Immunzellzustände in verschiedenen menschlichen Tumoren zu quantifizieren. Mit modernsten Bildgebungstechnologien erforschen wir, wie Tumorzellen das Immunsystem metabolisch modulieren und wie dies die Reaktion von Immunzellen auf Checkpoint-Inhibitor-Therapien (ICI) beeinflusst. Darüber hinaus untersuchen wir die mechanistischen Auswirkungen metabolischer Reprogrammierung in humanen Tumor-Organoiden.
Unsere Schwerpunkte sind:
- Metabolische Interaktionen: Aufklärung der Stoffwechselinteraktionen zwischen Immunzellen und Krebszellen.
- Neue Biomarker: Identifizierung metabolischer Biomarker zur Personalisierung von Therapiestrategien.
- Therapeutische Ziele: Untersuchung metabolischer Enzyme als Zielstrukturen zur Verbesserung der Krebsimmuntherapie.
Zusammenfassend verfolgen wir das Ziel, die metabolischen Interaktionen in der Krebsimmunologie besser zu verstehen und so die Entwicklung wirksamerer, personalisierten Krebstherapien zu unterstützen.

Dr. Felix Hartmann
Nachwuchsgruppenleiter – Systemimmunologie und Einzelzell-Biologie
DKFZ