Translationale Onkologie, Schwerpunkt Reverse Translation
Prof. Dr. Martin Sos
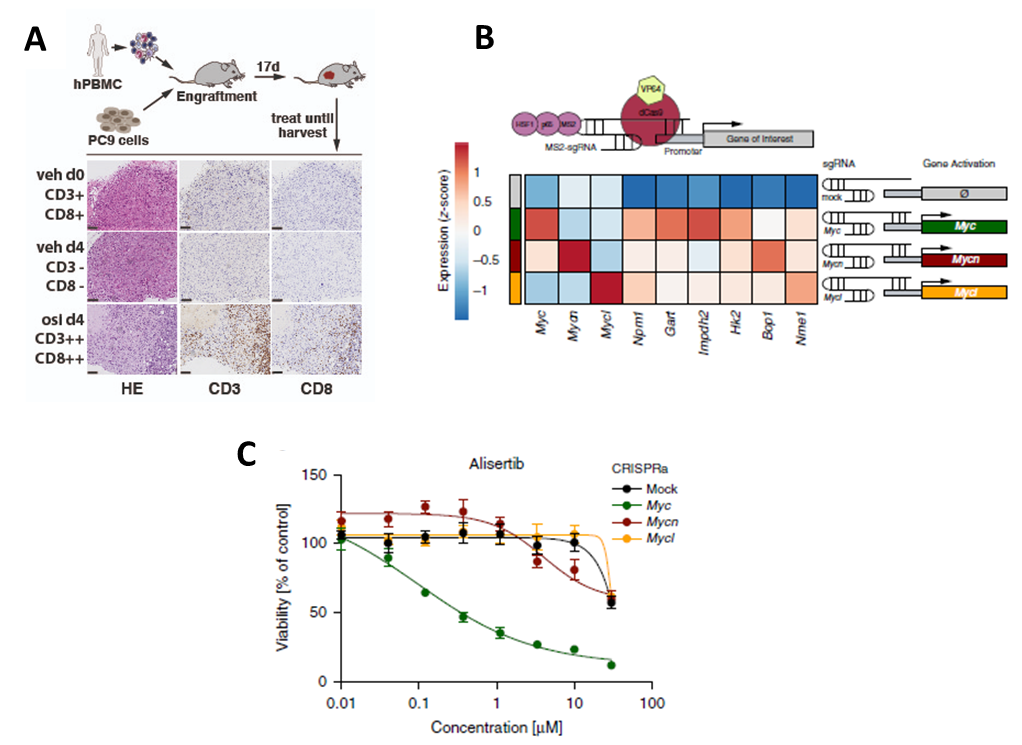
Die Entwicklung der Präzisionsonkologie, die auf die spezifische Hemmung onkogener Zielstrukturen abzielt, trug in den letzten Jahren entscheidend zum Erfolg translationaler Krebsforschung bei. Die Identifikation neuartiger treibender Onkogene, wie mutiertes EGFR bei Patient:innen mit Lungenadenokarzinom, sowie neue therapeutische Strategien haben die Behandlungskonzepte für nahezu alle Krebsarten grundlegend verändert. Trotz des beispiellosen Einflusses zielgerichteter Therapien auf das Gesamtüberleben ausgewählter Patient:innen ist deren Wirksamkeit durch das Nachwachsen resistenter Klone in nahezu allen Tumoren begrenzt. Ähnliche Prozesse spielen auch bei der primären und erworbenen Resistenz gegenüber immuntherapeutischen Wirkstoffen eine Rolle. Daher setzen wir uns intensiv dafür ein, molekulare Knotenpunkte zu identifizieren, die die Wirksamkeit dieser Medikamente durch Verstärkung der angeborenen und adaptiven Immunantwort gegen Krebszellen potenziell erhöhen können.
Unser Ansatz
Um die zellulären Netzwerke aufzudecken, die die Wirksamkeit von Medikamenten beeinflussen, nutzen wir CRISPR-basierte Gain- und Loss-of-Function-Experimente, einschließlich genomweiter Screens, Bulk- und Einzelzellsequenzierung sowie pharmakologische Störungen. Um die individuellen Charakteristika von Lungenkrebs und anderen Tumoren abzubilden, setzen wir zelluläre Modelle, Organoide und genetisch veränderte Mausmodelle ein. Zudem kombinieren wir innovative molekulare Zellbiologie-Technologien mit modernen Methoden der computergestützten Biologie, um die Entwicklung neuartiger Krebstherapien voranzutreiben.

Prof. Dr. Martin Sos
Abteilungsleiter - Partnerstandort München
LMU München
Translationale Onkologie (Schwerpunkt Reverse Translation) / Translational Oncology (focus on Reverse Translation)